Forskere skaber orden i en verden af molekylær uorden
I den biologiske verden er proteinerne de molekyler, der får ting til at ske. Almindeligvis, opfattes proteiner som molekylære maskiner, hvis veldefinerede strukturer er afgørende for, at de kan udføre deres funktion. Denne forståelse udfordres dog af en stor gruppe af proteiner, der, langt snarere end en maskine, ligner kogt spaghetti. Ny forskning fra Københavns Universitet bringer orden i vores forståelse af disse såkaldte uordnede proteiner.
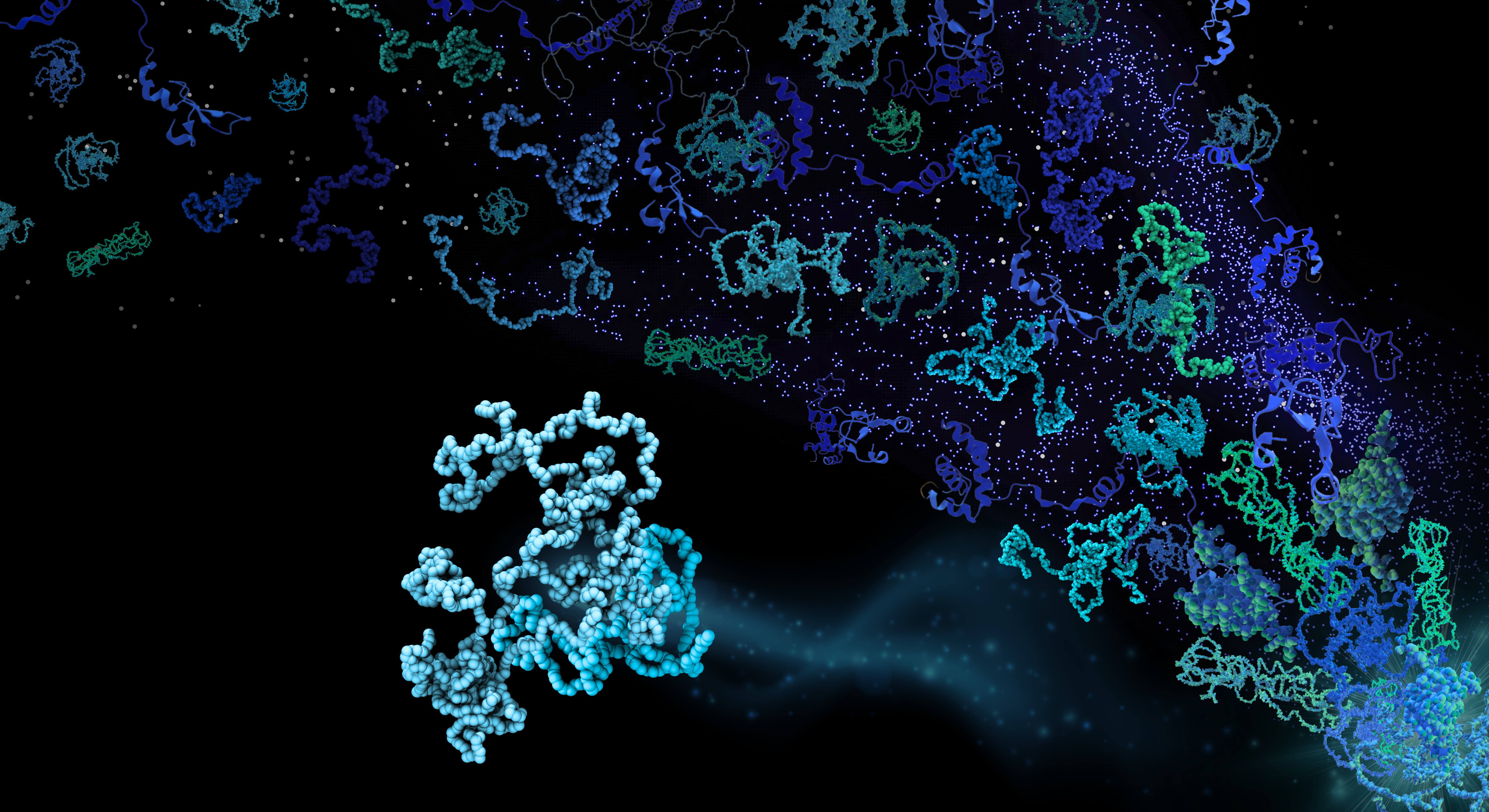
Proteinmolekyler spiller en helt central rolle i biologiske processer. Den udbredte forståelse af proteiner tilsiger, at hver proteintype har en specifik tredimensionel form, der muliggør proteinets funktion. Dette dogme blev udfordret ved opdagelsen af “uordnede proteiner”, som har vist sig at udgøre en tredjedel af alle proteiner. Trods det, at deres form konstant ændrer sig, har de uordnede proteiner helt afgørende betydning for cellernes funktion. Indtil nu, har vores forståelse af de strukturelle egenskaber af denne fascinerende klasse af proteiner været baseret på studier af ganske få eksempler. I ny forskning, offentliggjort i tidsskriftet Nature, har forskere fra Biologisk Institut på Københavns Universitet vist, hvordan alle (ca. 28.000) uordnede proteiner i menneskekroppen opfører sig.
- “Jeg har altid været fascineret af uordnede proteiner, fordi de synes at trodse de fleste gængse regler for, hvordan et protein skal opføre sig. Vi har, gennem de sidste 20 år, arbejdet på at finde ud af, hvordan disse mærkværdige proteiner ser ud, og om der er brug for nye regler til at beskrive dem. Vi er nu, for allerførste gang, blevet i stand til at studere strukturen af samtlige menneskelige uordnede proteiner og er således begyndt at skabe orden i denne verden af molekylær uorden,” siger professor Kresten Lindorff-Larsen, leder af NNF-centret, PRISM, hvor forskningen blev udført.
Formålet med PRISM-centret er at studere, hvordan genetiske varianter forårsager sygdom. Dette ved at kombinere beregningsmetoder fra både biofysik og maskinlæring, med metoder fra cellebiologi. Men da forskerne manglede viden om, hvordan de fleste uordnede proteiner så ud, kunne de end ikke begynde at overveje, hvordan mutationer i de gener, der koder for dem, kunne medføre sygdom.
- “Indtil for nylig, undersøgte vi de uordnede proteiner et ad gangen, og det var vigtigt at finde en måde, hvorpå vi kunne studere dem i større skala,” siger adjunkt Giulio Tesei, som er en af hovedforfatterne på den nye artikel. Giulio fortsætter: “Vi fandt en tilgang, hvor vi ved hjælp af eksperimentelle målinger på uordnede proteiner kunne udvikle en beregningsmodel til at forudsige deres egenskaber. Præcisionen og hurtigheden af denne model gør, at vi nu kan studere dem alle. ”
Den anden hovedforfatter, Anna Ida Trolle, siger: “Da jeg, som bachelorstuderende, begyndte på projektet, vidste jeg ikke, at man typisk blot undersøger ét eller to proteiner ad gangen. Så jeg var heldigvis ikke klar over, hvor skør en idé det var, da Giulio og Kresten foreslog, at jeg skulle studere omkring 28.000 proteiner. Men vi fandt hurtigt en måde at generere og holde styr på den store mængde data, og kunne udnytte den til at studere biologien og evolutionen af uordnede proteiner. Det har været megaspændende!”
Kresten Lindorff-Larsen konkluderer: “Det har været et udfordrende, men også ekstremt sjovt projekt — som kun har været muligt takket være de forskellige ekspertiser forskerne i PRISM-centret kunne bidrage med. Vi har taget nye skridt mod at koble de uordnede proteiners molekylære egenskaber med deres biologiske funktion — og mod forståelsen af deres enorme betydning for mange vigtige sygdomme. Man kan næsten sige, at vi endelig er begyndt at forstå de uordnede proteiners sprog.”
Forskningen er støttet af Novo Nordisk Fonden og EU's forsknings- og innovationsprogram Horizon 2020 under Marie Skłodowska-Curie aftale nr. 101025063.
Artikel i Nature
Conformational ensembles of the human intrinsically disordered proteome
Giulio Tesei, Anna Ida Trolle, Nicolas Jonsson, Johannes Betz, Frederik E. Knudsen, Francesco Pesce, Kristoffer E. Johansson & Kresten Lindorff-Larsen
Andet
I deres artikel "Conformational ensembles of the human intrinsically disordered proteome" giver Tesei, Trolle og kolleger ved Københavns Universitet det første indblik i de strukturelle egenskaber af alle uordnede regioner og proteiner i det humane proteom. Her kort film om emnet:
Kontakt
Adjunkt Giulio Tesei
Mail: giulio.tesei@bio.ku.dk
Professor Kresten Lindorff-Larsen
Mail: lindorff@bio.ku.dk
Tlf: 3532 2027
Af/ Sidsel K. Henriksen
Mail: sidsel.henriksen@bio.ku.dk
Tlf: 3533 4147
