Forskere får unikt indblik i cellers indre liv
Cellers indre skifter konstant form og det begrænser vores forståelse af dem til det øjebliksbillede vi bl.a. ser i et mikroskop. Men med en ny computermodel fra Københavns Universitet kan forskere nu bedre forudsige, hvordan de mest dynamiske elementer i cellen udvikler sig. Et fremskridt som måske kan hjælpe i forståelsen af Alzheimers, Parkinson, kræft og andre cellesygdomme i fremtiden.
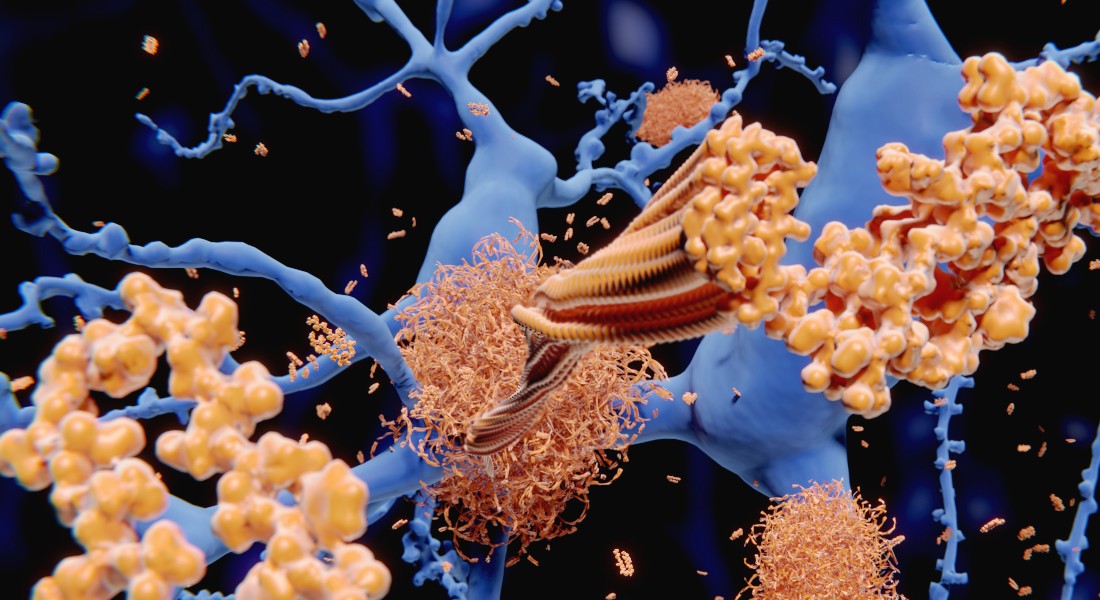
Cellerne er den mindste levende bestanddel i alle organismer. I et gigantisk samarbejde sørger billioner af dem for, at alle biologiske processer i menneskekroppen kører som de skal. For at den enkelte celle skal fungere korrekt er dens forskellige funktioner fordelt i små molekylære ”rum”.
Men fordi mange af disse rum hele tiden skifter form er det svært at få andet end øjebliksbilleder af det liv, der foregår i celler. Og det gør det vanskeligt at undersøge, om en bestemt celle vil udvikle fejl, som kan lede til sygdomme som fx kræft og hjernesygdommene Alzheimers og Parkinson.
Men nu har forskere på Linderstrøm-Lang Centret for Proteinvidenskab ved Biologisk Institut på Københavns Universitet udviklet en ny computermodel, som kan hjælpe med bedre at forstå og forudsige, hvordan cellerne organiserer sig. Modellen kan simulere, hvordan proteiner i cellen samarbejder om livsvigtige opgaver.
”Vi har i mere end hundrede år vidst, at menneskets celler er højt organiserede, og at forskellige biologiske funktioner findes i forskellige rum i cellen. I de sidste 10 år har vi lært om en ny type organisering af celler, som er helt anderledes end de strukturer, vi hidtil har kendt. Men da disse nyopdagede strukturer er meget dynamiske og skifter form og sammensætning hele tiden, er det svært at forstå, hvordan de hænger sammen, og hvad der styrer deres dannelse. Derfor har vi udviklet en algoritme, som kan forudsige deres egenskaber,” forklarer professor Kresten Lindorff-Larsen.
En revolution i forståelsen af cellen
Værktøjet er en avanceret computermodel, der bygger på biofysiske målinger, og en form for kunstig intelligens, der gør det muligt for forskerne at simulere forskellige scenarier i den måde molekylerne i cellen interagerer med hinanden. Kresten Lindorff-Larsen sammenligner det lidt med forudsigelsen af vejret, som vi kender den fra vores vejr-apps.
”De metoder vi tidligere havde tilgængelige ville svare til, at vi måske kunne forudsige vejret nogle minutter frem i tiden. Men i stedet for meget detaljerede forudsigelser, har vi bygget en model, som giver os det store billede og laver overordnede forudsigelser,” forklarer Kresten Lindorff-Larsen.
Forskerne har særligt undersøgt en proces i cellen hvor forskellige typer af molekyler, såsom protein og RNA, spontant samler sig sammen for at samarbejde om en opgave.
”Cellen er ikke bare en pose, hvor tingene foregår tilfældigt. Den er ekstremt organiseret, og der er meget lidt plads. Derfor samler den mange af sine molekyler i små dråber alt efter hvilken proces, de skal samarbejde om, og når de er færdige adskilles de igen. Lige indtil der opstår fejl, så de ikke længere udfører opgaven korrekt. Vores ny computermodel kan beskrive denne organisering i hidtil uset detalje,” forklarer postdoc Giulio Tesei.
Kræft, Alzheimers og Parkinson
Disse fejl giver sig til udtryk i en lang række sygdomme, som kræft, Alzheimers og Parkinson. Zoomer man ind på en hjernecelle hos patienter med Parkinson, kan man se proteiner, der er klumpet sammen og som danner aflange stave. En proces som mange læger og forskere tidligere har observeret og studeret, men som det nu vil være lettere at forstå og måske på sigt behandle.
”Et mål med modellen er, at vi kan gå ind og identificere molekyler og processer i cellen, som er centrale i dannelsen af de her stave, før de bliver dannet. På den måde kan man bedre målrette behandlingen, inden de begynder at samle sig uhensigtsmæssigt,” siger Kresten Lindorff-Larsen.
Forskerne understreger, at modellen ikke kan stå alene, men skal anvendes sammen med eksperimentelle data. Forskningen er udgivet i det videnskabelige tidsskrift PNAS og finansieret af Lundbeckfonden og EU’s Horizon 2020 program. Adgang til pre-print her, som ikke kræver abonnement.
Kontakt
Kresten Lindorff-Larsen
Professor
Biologisk Institut
Københavns Universitet
Telefon: +45 35 32 20 27
Mail: lindorff@bio.ku.dk
Giulio Tesei
Postdoc
Biologisk Institut
Københavns Universitet
Telefon: +45 35 33 78 95
Mail: giulio.tesei@bio.ku.dk
Michael Skov Jensen
Journalist
Det Natur- og Biovidenskabelige Fakultet (SCIENCE)
Københavns Universitet
Mobil: 93 56 58 97
Mail: msj@science.ku.dk
